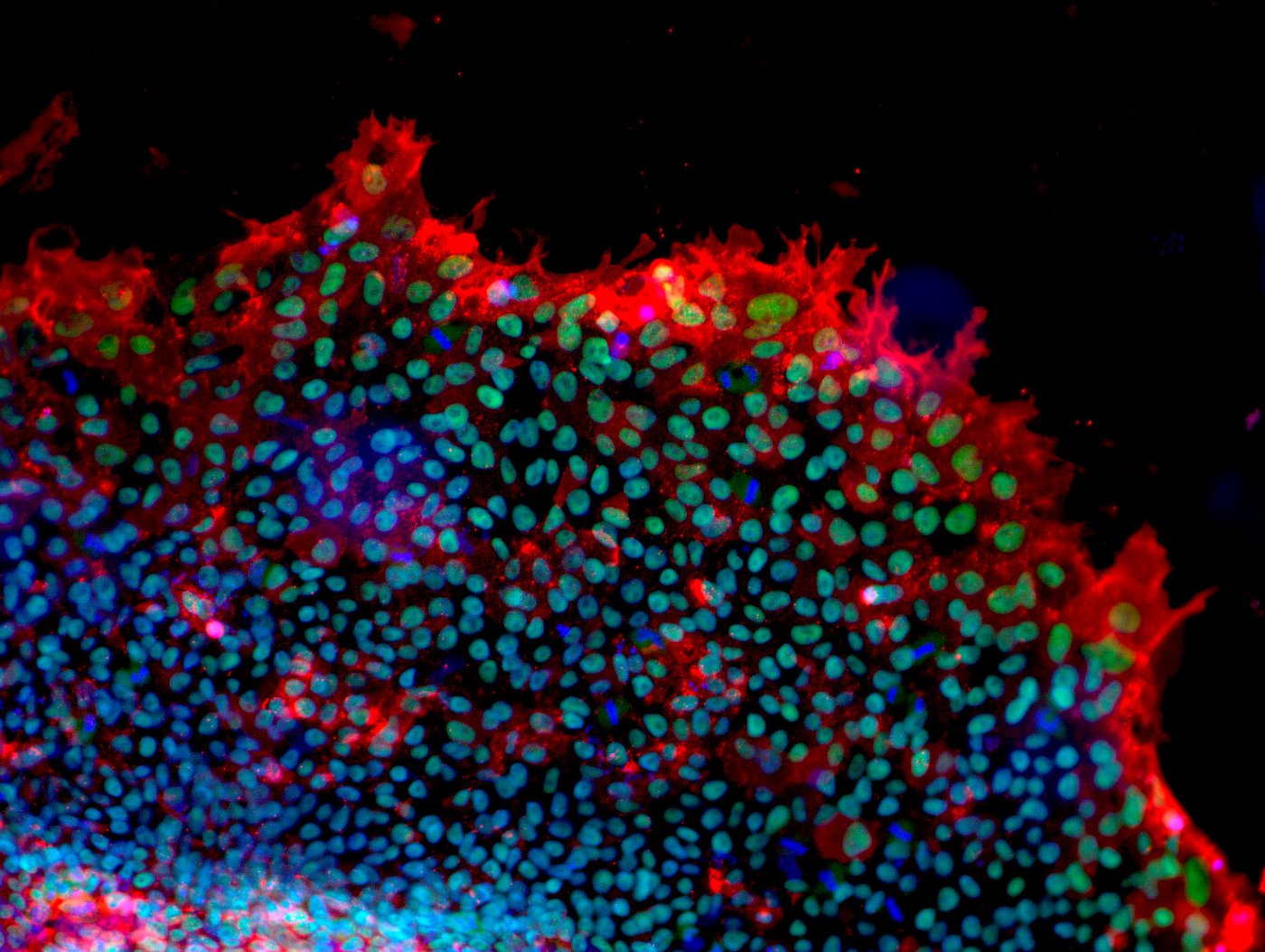
Humane iPSC-Kolonie - Expression von Pluripotenzproteinen an der Zelloberfläche (rot) und im Zellkern (grün; zusätzlich gefärbt mit DAPI, blau) [Quelle: Institut für biomedizinische Technologien - Zellbiologie, UK Aachen]
Embryonale Stammzellen (ES-Zellen) finden sich nicht im ausgewachsenen Körper. Sie treten nur in einer sehr frühen Phase der Embryonalentwicklung auf, der Blastozyste. Dies ist ein Entwicklungsstadium, das ein menschlicher Embryo am 5. Tag nach der Befruchtung durchläuft. In diesem frühen Stadium wurden noch keine Organe ausgebildet, es handelt sich lediglich um eine Art Zellhaufen (siehe Abbildung 2).
Um embryonale Stammzellen zu erhalten, muss die äußere Zellschicht der Blastozyste zerstört werden, so dass die übrig gebliebenen Zellen der inneren Zellmasse (Embryoblast) isoliert und im Labor in Zellkulturen überführt werden können (siehe Abbildung 3). Diese innere Zellmasse, also die isolierten Zellen, haben das Potential, sich unter kontrollierten Bedingungen zu jedem Zelltyp des menschlichen Körpers zu entwickeln, jedoch können die embryonalen Stammzellen keinen vollständigen Organismus mehr bilden.
Diese Eigenschaft bezeichnet man als Pluripotenz (lat. in etwa Vielvermögen); im Gegensatz zu den totipotenten, einzelligen Embryonen (=Ursprungszelle), die stets ganz am Anfang der individuellen Entwicklung stehen. Pluripotente Stammzellen zeichnen sich durch die Fähigkeit aus, dass sie alle drei Keimblätter (Ektoderm, Entoderm, Mesoderm) hervorbringen können. Sie sind somit noch auf keinen bestimmten Gewebetyp festgelegt (siehe Abbildung 4).
In der Forschung wird weltweit sowohl mit verschiedenen tierischen als auch mit humanen (menschlichen) embryonalen Stammzellen (hES-Zellen) gearbeitet. Im Labor ist es möglich, aus embryonalen Stammzellen durch Zugabe bestimmter Wachstumsfaktoren bestimmte Zelltypen, z.B. Nervenzellen, herzustellen. Dies wird als Differenzierung bezeichnet (siehe Abbildung 4). Zudem können die Zellen im Labor vermehrt und in Zellkultur gehalten werden. Für die Herstellung von hES-Zellen werden in der Regel Blastozysten verwendet, die für eine künstliche Befruchtung (In-vitro-Fertilisation) produziert wurden, aber nicht mehr für die Implantation genutzt werden. In Deutschland ist die Herstellung von hES-Zellen im Labor verboten. Es ist aber möglich, hES-Zellen für die Forschung unter strengen Auflagen aus anderen Ländern zu importieren.
Eine weitere Möglichkeit, embryonale Stammzellen herzustellen ist das sogenannte therapeutische Klonen, der ein Zellkerntransfer (engl. somatic cell nuclear transfer (SCNT)) zugrunde liegt. Bei einer gespendeten Eizelle wird dazu der Zellkern entfernt und stattdessen der Zellkern einer somatischen Zelle (Körperzelle) eingesetzt. Die über dieses Verfahren erhaltenen Zellen sind ebenfalls pluripotent. Das Verfahren wird bisher nur an tierischen Zellen angewandt. Weitere Informationen zum Zellkerntransfer finden Sie auf den Seiten des Deutschen Referenzzentrums für Ethik in den Naturwissenschaften.
Abbildung 2 und 3 wurde freundlicherweise vom Deutschen Referenzzentrum für Ethik in den Biowissenschaften zur Verfügung gestellt.
Adulte Stammzellen (=Gewebestammzellen) sind bereits spezialisierte Stammzellen, die nur noch bestimmte Zelltypen des menschlichen Körpers bilden können. So können beispielsweise Hautstammzellen nur verschiedene Zelltypen der Haut, nicht aber Blut- oder Nervenzellen hervorbringen. Diese Fähigkeit bezeichnet man als Multipotenz(lat. in etwa Mehrfachvermögen). Multipotente Stammzellen können sich zu verschiedenen Zelltypen eines bestimmten Gewebes entwickeln, d.h. sie sind in der Regel nur noch in der Lage, Zellen eines bestimmten Keimblattes auszubilden (vgl. Abb. 4). Inzwischen wird angenommen, dass adulte Stammzellen in allen Geweben des menschlichen Körpers vorkommen und es, zum Beispiel im Falle einer Verletzung, regenerieren können. Wird etwa die Haut durch eine Schnittwunde oder Verbrennung verletzt, werden die dortigen Hautstammzellen aktiviert und bilden neue Hautzellen, durch Teilung und Differenzierung.
Die Wissenschaft hat in den vergangenen Jahren immer neue Typen von adulten Stammzellen in Geweben entdeckt, in denen man zuvor keine Stammzellen vermutet hatte. Ging man zum Beispiel früher davon aus, dass die Gewebe des menschlichen Auges sich nicht regenerieren können, weiß man heute, dass es etwa in der Hornhaut des menschlichen Auges Stammzelldepots gibt. Die wohl bekannteste Art von adulten Stammzellen sind jene des blutbildenden Systems, welche im Knochenmark zu finden sind. Sie kommen bereits seit 50 Jahren zur erfolgreichen Behandlung von Erkrankungen des blutbildenden Systems (etwa Leukämien) zum Einsatz.
Besonders hervorzuheben unter den adulten Stammzellen sind die Mesenchymalen Stammzellen (MSCs), die ebenfalls im Knochenmark zu finden sind. MSCs bieten ein großes Potential für viele therapeutische Anwendungen und werden bereits in einer Vielzahl von klinischen Studien erforscht.
Der Nobelpreis für Medizin ging im Jahr 2012 an den japanischen Stammzellforscher Shin’ya Yamanaka und seinen britischen Kollegen Sir John Gurdon. Basierend auf einer Methode von Gurdon war es Yamanaka gelungen, ausgereifte Zellen eines erwachsenen Organismus durch Verwendung sogenannter Transkriptionsfaktoren zu verjüngen (reprogrammieren), also die Entwicklung der Zellen in einen frühen embryonalen Zustand zurückzuversetzen. Danach waren diese Zellen fast so vielseitig wie embryonale Stammzellen und konnten viele unterschiedliche Gewebetypen bilden, z.B. Nervenzellen oder Blutzellen (siehe Abbildung 5). Sie sind somit ebenfalls pluripotent, wie auch die embryonalen Stammzellen.
Zunächst gelang die Reprogrammierung nur mit tierischen Zellen, im Jahr 2007 schafften es verschiedene Forschergruppen auch menschliche Zellen zu reprogrammieren. Seither haben sich die anfangs noch sehr ineffizienten und potentiell riskanten Techniken der Reprogrammierung deutlich weiterentwickelt.
Heutzutage sind Zelllinien vorhanden, welche die Transkriptionsfaktoren nicht dauerhaft im Erbgut haben und eine gute Grundlage für wissenschaftliche Fragestellungen geben. Ob iPS-Zellen den ES-Zellen in ihren Fähigkeiten tatsächlich vollständig entsprechen, ist eine bislang ungeklärte Frage. iPS-Zellen haben gegenüber ES-Zellen den Vorteil, dass für ihre Gewinnung keine Embryonen verwendet werden müssen. Zudem sind die reprogrammierten Zellen mit dem Immunsystem des Zellspenders kompatibel und somit für therapeutische Zwecke besonders vielversprechend einsetzbar.
Neben adulten und embryonalen Stammzellen gibt es noch weitere Stammzell-Typen. Insbesondere zu nennen sind hier die Nabelschnurblut-Stammzellen, die im Blut der Nabelschnur oder der Plazenta nach der Abnabelung enthalten sind. Nabelschnurblut-Stammzellen sind nach heutigem Erkenntnisstand nicht pluripotent. Ihr Potential ist aber höher als das anderer, multipotenter Körperstammzellen.
Im Gegensatz zu (adulten) Stammzellen können die spezialisierten Vorläuferzellen des erwachsenen Organismus immer nur weitere Zellen eines speziellen Zelltyps hervorbringen, aus einer Blutzelle zum Beispiel kann bei der Teilung keine Leberzelle oder Haarzelle entstehen. Diese Eigenschaft nennt man unipotent (lat. in etwa Einvermögen).
Weiteres zur Definition von Stammzellen, Ihren Eigenschaften und Kategorien sowie dem Stand der Forschung finden Sie unter http://www.drze.de/im-blickpunkt/stammzellen
Einen bestimmten Zelltyp - wie beispielsweise ein Neuron - aus einer bereits differenzierten, somatischen Zelle - z.B. einer Hautzelle - herzustellen ist möglich, indem man aus der Ausgangzelle (Haut) zuerst eine pluripotente Stammzelle generiert (Dedifferenzierung), um aus dieser anschließend den spezialisierten „Wunsch-Zelltyp“ (Neuron) zu generieren (Redifferenzierung; vgl. Abbildung 5). Inzwischen sind Wissenschaftler/innen allerdings ebenso in der Lage, eine spezialisierte Zelle „A“ direkt, d.h. ohne den Umweg über ein pluripotentes Intermediat, in eine andere spezialisierte Zelle „B“ umzuprogrammieren. Diesen Prozess bezeichnet man als Transdifferenzierung. Dies funktioniert, ähnlich wie die zuvor beschriebenen Differenzierungsprozesse, indem die Zellen mit Zelltyp-spezifische Transkriptions- und Wachstumsfaktoren in Kontakt gebracht werden (siehe Abbildung 6). Da kein Umweg über iPS-Zellen notwendig ist, kann man durch Transdifferenzierung schneller als mit anderen Methoden die gewünschten, spezialisierten Zellen generieren. Es wird zudem kein embryonales Gewebe benötigt. Ein Nachteil ist jedoch, dass die Zellen zumindest einen Teil ihres zellulären „Gedächtnisses“ (bspw. epigenetische Markierungen) beibehalten und somit nicht komplett vergleichbar mit ihrem natürlich vorkommenden “Abbild” sind.